Rx腎臓
Acute pericarditis
急性心膜炎は、前傾姿勢で軽減する胸痛、心膜摩擦擦過、心電図上のびまん性ST上昇を呈する。
急性心膜炎の一般的な原因としては、しばしばコクサッキーBウイルスによるウイルス感染、MI後の状態などがある。
ステップ1:病気の診断 '
この患者は、前かがみになると楽になる胸痛、発熱、びまん性の心電図ST上昇を認める。これらの所見は急性心膜炎(心膜炎症)を示唆している。心膜炎は一般に、仰臥位で増悪する胸痛、摩擦摩擦、心電図上のびまん性ST上昇とPR陥凹を引き起こす。
ステップ2:疾患のメカニズム
心膜炎はコクサッキーBウイルスなどのウイルス感染に起因することもあれば、今回のようにウイルス性上気道感染に続いて発症することもある。過去には、心膜炎が未治療の心筋梗塞に数週間から数カ月続いて起こることがあった(Dressler症候群)。しかし,このような心膜炎は現在ではまれである。おそらく,この患者で血管形成術が行われたように,心筋梗塞と心筋梗塞後の心膜炎に対する治療がより早く,より積極的に行われるようになったためであろう。その他の原因としては、ループスや末期腎不全(尿毒症性心膜炎)がある。
Nephrogenic diabetes insipidus
リチウムは双極I型障害の第一選択薬であるが、NDIによる多尿を引き起こす可能性がある。
ステップ1:薬の副作用
この患者は双極性Ⅰ型障害の病歴があり、気分安定薬で治療されるであろう。双極性障害の第一選択薬はリチウムである。リチウムの一般的な副作用は、腎性尿崩症(NDI)であり、リチウムの集合管に対する作用により、腎臓がADHに反応できなくなる。診断は尿浸透圧の測定によって行われるが、尿濃縮ができないため、水分欠乏でも浸透圧は低下する。この症例では、尿浸透圧の増加はわずかであったが、通常、水分欠乏では尿浸透圧は600mOsm/kgを超えるはずである。ADHアナログであるデスモプレシンを投与しても、腎臓が反応しないため、NDIでは濃縮尿は得られない。この点がNDIと中枢性DI(CDI)との違いである。NDIはリチウム投与中止後も可逆的であるが、長年の使用により不可逆的になることもある。
間質性腎炎はリチウムでみられることがあるが、クレアチニンと尿中白血球の増加を引き起こす。
原発性多飲症は、水分を摂取する生理的刺激がないのに水分が過剰に摂取されることを特徴とする。
甲状腺機能低下症は、典型的には、寒冷不耐症、疲労、エネルギー低下、体重増加、徐脈などの典型的な症状で発症する。
ADH不適正分泌症候群(SIADH)は、多くの薬剤、腫瘍過程、および肺疾患と関連している。SIADHは、特定の抗精神病薬および/または抗うつ薬の副作用の可能性がある。
下垂体腺腫は、腺内のADH分泌を低下させ、多尿を引き起こすことにより、CDIを引き起こすことがある。
Decreased renal blood flow
ステップ1:病気の診断
BUNとクレアチニンの上昇、BUN:クレアチニン比の高値(20:1以上)、FENa<1%、心筋梗塞治療後の尿量減少の既往から、この患者は腎前性急性腎障害である。
ステップ2:疾患機序
心筋梗塞後の低血圧(収縮期血圧90mmHg以下)から明らかなように、この患者は心原性ショックを経験した可能性が高い。このため腎血流が減少し、糸球体濾過量(GFR)が低下したため、血清クレアチニンとBUNが上昇した。腎前性AKIでは、近位尿細管でのナトリウムと水の再吸収が増加する。これにより尿細管尿素濃度が上昇し、尿素の再吸収が促進されます。このため、BUNが上昇し、血清BUN/クレアチニン(BUN:Cr)比が上昇する(20:1以上)。さらに、腎前性AKIでは、ナトリウムの再吸収が亢進するため、FENaは1%以下となる。
急性尿細管壊死は腎内AKIの一形態で、BUN:Cr比が10:1~15:1、FENaが2%以上であり、尿細管上皮細胞と尿検査上の泥褐色の顆粒および上皮細胞鋳型を認める。
間質性腎炎は腎内AKIの一形態で、BUN:Cr比が10:1~15:1であり、尿検査で好酸球や白血球の鋳型を認めることがある。
糸球体腎炎では血尿と蛋白尿がみられる。
動脈硬化性腎動脈狭窄症は二次性高血圧を呈する。
Coronary artery disease
ステップ1:病気の診断
この患者は、呼吸困難、頸静脈拡張(JVD)、S3心音、浮腫を呈し、うっ血性心不全を示唆している。胸部X線では心肥大のシルエットが認められ、心電図では心室肥大の所見はない(例えば、Iの高QRS電圧、左の増大ベクトル、V4-V6など)。これらの所見は、症状の原因として心不全(HF)を示唆している。
ステップ2:疾患のメカニズム
収縮期HFの最も一般的な原因は冠動脈疾患による虚血性心疾患である。心筋梗塞の既往(Q波)、胸痛の既往、2型糖尿病(CADの危険因子)の既往が裏付けになる。拡張型心筋症(例えば、ウイルス、アルコール、アドリアマイシンなど)でもQ波はみられうることに注意する。
コロナウイルスやコクサッキーウイルスBの感染は、拡張型心筋症やHFを引き起こすウイルス性心筋炎を引き起こす可能性がある。しかし、これらの収縮期HFの原因は、冠動脈疾患ほど一般的ではなく、特に糖尿病や胸痛の既往がある患者では注意が必要である。
アルコールの過剰摂取も拡張型心筋症の原因となる。既往歴と心電図から虚血性心疾患の可能性が高い。
肥大型心筋症や拡張型心筋症の原因となるサルコメア遺伝子の変異は若年層にみられ、虚血性心疾患よりもはるかにまれである。
大動脈弁狭窄症(AS)は、高後負荷に対する筋細胞の肥大により非収縮期心不全を引き起こす。この患者にはAS雑音がなく、収縮期心不全がある。
cystoscopy
血尿は糸球体疾患、結石、感染症を除外して評価する。適切な患者には膀胱鏡検査を行い、膀胱癌の有無を評価する。
ステップ1:診断テスト
無症候性血尿の評価は、糸球体疾患(血清クレアチニン正常、尿蛋白なし)、腎結石(腎超音波検査またはCT正常)、感染症(尿中WBCなし、尿培養正常)の除外から始まる。喫煙歴のある高齢患者では、次に考えられる疾患は膀胱の移行細胞癌である。これは、尿細胞診、またはより頻繁には膀胱鏡検査で評価できる。膀胱鏡検査では、腫瘍を可視化し、顕微鏡分析と癌の悪性度分類のために組織を採取することができる。
Anitschkow cell
Aschoff体:リウマチ熱に特徴的な肉芽腫性病変である
Anitschkow cell(caterpillar cell),細胞質が豊富で核の中心にクロマチンが細長く集合した活性化マクロファージ
リウマチ性心疾患は僧帽弁狭窄症を引き起こすことがあり、この狭窄症は後期拡張期雑音を特徴とする。リウマチ性心疾患は、A群溶連菌の咽頭感染によるリウマチ熱に起因することがある。
リウマチ性心疾患の病理学的特徴として、T細胞、形質細胞およびアニツコフ細胞からなるアショフ小体があり、これはリウマチ性心疾患の病徴である。
Rx腎臓
ウィルムス腫瘍
ウィルムス腫瘍は触知可能な脇腹の腫瘤として現れ、時に血尿や腹痛を伴う。
ウィルムス腫瘍の合併症には、肺や肝臓への転移がある。
ステップ1:病気の診断
この患者は、小児期に最もよくみられる腎悪性腫瘍であるウィルムス腫瘍に特徴的な、触知可能な腹部/脇腹の腫瘤を呈している。通常2~4歳の小児で診断されるウィルムス腫瘍は、この患者のように腹痛と血尿を伴うことがある。
ステップ2:合併症
ウィルムス腫瘍は肺や腹部のリンパ節、肝臓に転移することが多く、病期を決定するには画像診断が必要です。肺転移は胸部X線検査、CT検査、肝機能検査で発見されます。先天性WAGR(ウィルムス腫瘍、無虹彩症Aniridia、泌尿生殖器異常Genitourinary anomalies、および発達遅延の範囲Range of developnmental delays)症候群との関連がある;患者は、知的障害、無虹彩症(眼球虹彩の部分的または完全な欠如)、陰睾(停留精巣)などの泌尿生殖器異常、およびBeckwith-Wiedemann症候群(巨舌症、巨人症、半身肥大)についても評価されるべきである。
Bartter syndrome
バーター症候群は、ヘンレ太い上行脚のNa+/K+/2Cl-トランスポーターの変異に起因する低カリウム血症および代謝性アルカローシスのまれな遺伝性原因である。
バーター症候群は、尿中カルシウム排泄量の増加や尿濃縮能の低下など、フロセミドと同様の尿細管作用を引き起こす。
ステップ1:病気の診断
この患者の疲労と脱力感は、高度の低カリウム血症によるものであろう。低カリウム血症は、下痢、嘔吐、利尿剤の使用などによることが多いが、ここではこれらの原因がない。父親の腎障害の病歴から、まれな遺伝性の原因が考えられる。多尿、希釈尿、多飲、体重増加不良、低血圧、代謝性アルカローシス(血清重炭酸塩の増加)、尿中カルシウム増加も認められることから、常染色体劣性遺伝性疾患であるバーター症候群と診断される可能性が最も高い。これは、ヘンレの太い上行脚のNa+/K+/2Cl-トランスポーターの欠損によって起こる。
ステップ2:薬物機序
バーター症候群の患者は、同じくNa+/K+/2Cl-トランスポーターに作用するフロセミドなどのループ利尿薬を服用している患者と同様の代謝異常を示す。フロセミドはまた、低カリウム血症、代謝性アルカローシス、カルシウム排泄の増加(時に低カルシウム血症を伴う)を引き起こす。尿中の過剰なナトリウムの喪失は容積減少を招き、血清レニンとアルドステロンの濃度を上昇させ、尿中のカリウム喪失を引き起こす。間質濃度勾配を形成するのに必要なループでのナトリウム再吸収が不足するため、尿濃縮能が低下する(尿浸透圧が低い)。
Thromboangiitis obliterans
閉塞性血栓血管炎は、末梢動脈疾患と同様の症状を示す、血栓性の小〜中枝閉塞性血管炎である。
閉塞性血栓血管炎はタバコを吸う人によくみられる。
Constrictive pericarditis
収縮性心膜炎は、心膜組織の弾力性を失わせる線維性組織の増殖を特徴とする。右心不全の徴候を引き起こすことがある。
原因としては、ウイルス感染、放射線治療後、手術後の瘢痕化、全身性エリテマトーデス、リウマチ熱などが挙げられる。
ステップ1:病気の診断
この患者は、労作時の呼吸困難、心膜石灰化、吸気による頸静脈圧の上昇(Kussmaul徴候)があり、収縮性心膜炎に一致する。この病態は、右心不全と同じ徴候および症状(肝腫大、頸静脈拡張、浮腫、体重増加、肺crackles)を示す。収縮性心膜炎は、心膜組織の弾力性を失わせる線維組織の増殖と石灰化によって特徴づけられる。CTスキャンまたは心エコー検査で診断され、肥厚した石灰化した心膜が確認されます。
ステップ2:発症機序
心収縮性心膜炎の原因としては、胸部放射線、心臓手術の既往、ウイルス、真菌、寄生虫感染、結核、狼瘡やリウマチ熱などの炎症性疾患などがあります。
ACE阻害薬による高カリウム血症
ACE阻害薬は高血圧や心不全の治療の第一選択薬である。ACE阻害薬は高カリウム血症を引き起こすことが知られており、スピロノラクトンのようなカリウムを節約する利尿薬と併用すると、そのリスクが高まる。
アミオダロン
カリウムチャネルを遮断すると心筋活動電位の第III相が延長し、その結果有効不応期が延長する。
アミオダロンはカリウムチャネル遮断薬であり、甲状腺異常、肺線維症、肝毒性と関連している。
ステップ1:副作用
この患者の体重減少、震え、寒いのに薄着であることは甲状腺機能亢進症の状態を示している。甲状腺機能亢進症は人を暑く感じさせることがあり、そのため患者の季節外れの薄着はそのためである。甲状腺機能亢進症を含む甲状腺異常は、クラスIIIの抗不整脈薬であるアミオダロンの一般的な副作用である。アミオダロンは、肺線維症、肝毒性、甲状腺機能低下症/甲状腺機能亢進症、青色/灰色の皮膚沈着、光皮膚炎、神経学的作用、便秘、心血管作用(心不全、心ブロック、徐脈)とも関連している。
ステップ2:薬物メカニズム
クラスIIIの抗不整脈薬はカリウムチャネルを遮断する。このクラスの薬剤には、ソタロール、イブチリド、ドフェチリド、アミオダロンなどがある。アミオダロンはクラスI、II、IVの抗不整脈薬の特性も持っているが、クラスIIIの抗不整脈薬としてカリウムチャネルを遮断することが主な効果である。電位依存性低速カリウムチャネルを遮断することにより、心筋活動電位の第3相が延長し、その結果、有効不応期が延長する。これらの効果を図に示す。
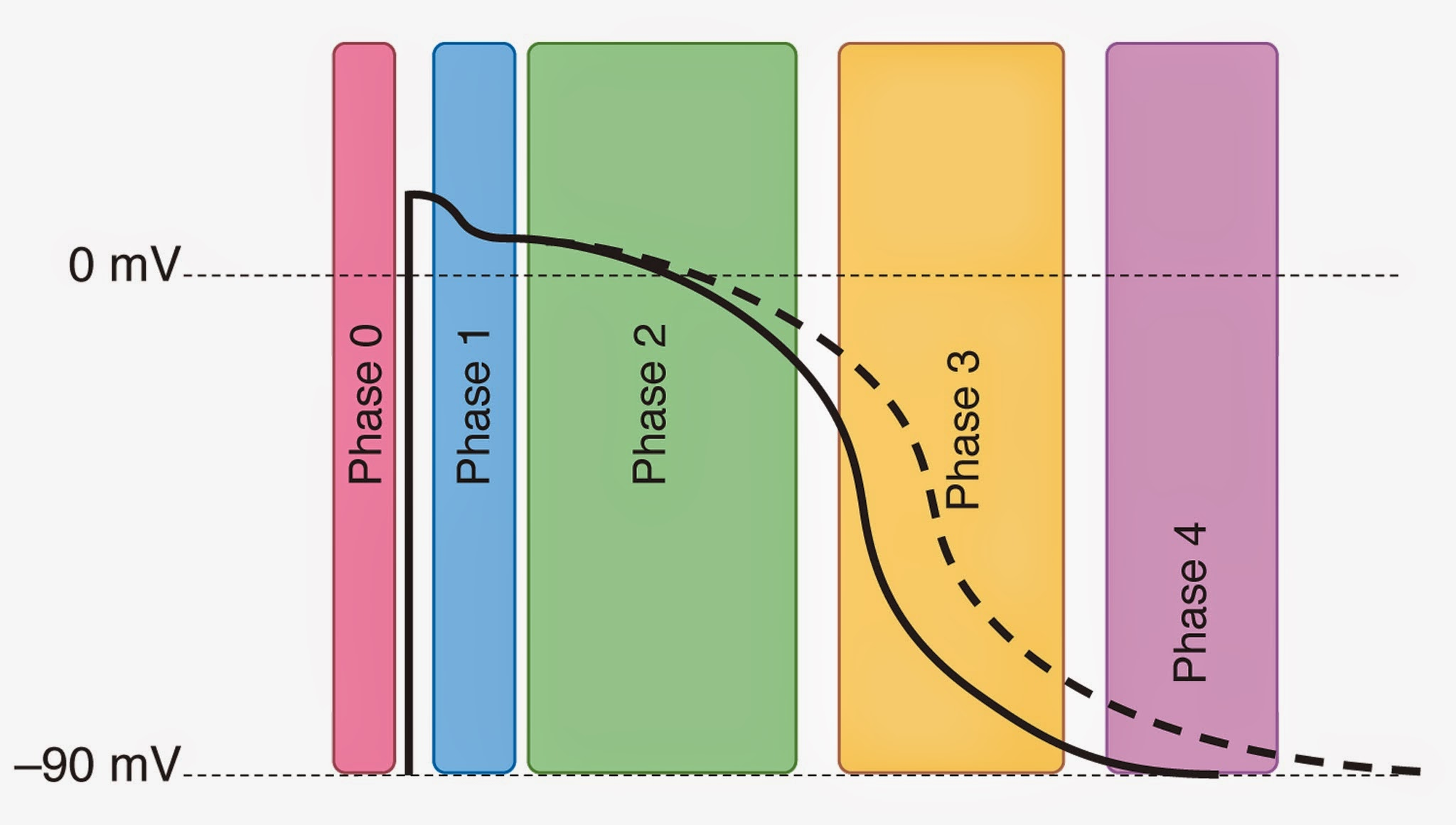
クラスIIIの抗不整脈薬は活動電位のアップストローク、Na+/K+-ATPaseの活性、カリウム透過性を増加させない。筋小胞体からのイオンの放出には影響を与えない。
サイアザイド系利尿薬
サイアザイド系利尿薬は高血圧の治療に用いられる。
サイアザイド系利尿薬は、電解質排泄の増加とそれに続く体液減少の結果として、低カリウムや代謝性アルカローシスを引き起こす可能性がある。
ステップ1:薬物療法
この患者は、高血圧、高脂血症、糖尿病の治療薬を服用している。臨床検査の結果、低カリウム血症と高重炭酸塩が認められる。高炭酸水素血症は、代謝性アルカローシス、または重度の呼吸性アシドーシスの代償としてみられるが、肺所見がないことから、その可能性は低い。低カリウム血症と代謝性アルカローシスは、サイアザイド系やループ利尿薬などの利尿薬で説明できる。サイアザイド系薬剤は高血圧の治療によく用いられるが、糖尿病や高脂血症の患者では血清グルコースや脂質値を上昇させる可能性があるため、使用を避けられることがある。しかし、末梢浮腫の管理など利尿作用が必要な場合には、高血圧患者に使用されることもある。
ステップ2:薬の副作用
サイアザイド系利尿薬とループ系利尿薬はいずれも、一般に、体液量の減少、カリウムと水素イオンの排泄増加の結果として、低カリウムと代謝性アルカローシスを引き起こす。利尿薬による体積減少がレニン-アンジオテンシン-アルドステロン系を活性化し、アルドステロン濃度が上昇する。高アルドステロンと尿流量の増加は、ループ利尿薬とサイアザイド利尿薬の両方で見られる低カリウム血症も引き起こす。
運動と減量
有酸素運動、減量、高強度スタチン療法は、死亡率や有害心血管系イベントを減少させる効果が証明されている介入である。
BMIが高く、HbA1cが糖尿病域、HDLコレステロール値が著しく低下(正常値は男性で40mg/dL以上)。これらはすべて心血管疾患のリスクを高める因子である。LDL値は130mg/dL未満、TG値は男性で40~160mg/dLであるべき。死亡率を下げるために減量、運動、高強度スタチン療法がある。
マグネシウムの再吸収
マグネシウムは主にヘンレ上行ループで再吸収されるが、これはイオンの濃度勾配による受動的拡散によるものである。
ステップ1:正常な構造/機能
マグネシウムは体内の他の分子とは異なり、ホルモンによって調節されることはない。血液中のマグネシウム濃度は腎臓によって調節されている。ヘンレ太い上行脚ループはマグネシウムのホメオスタシスの主要部位であり、マグネシウム再吸収の60~70%を占めている。したがって、太い上行脚ループでの輸送を阻害すると、マグネシウムの再吸収が著しく低下する。ヘンレ上行ループには、カリウムの再利用に必要な腎外髄質カリウムチャネルとNa+/K+/2Cl-共輸送体が存在する。これらのチャネルを介したイオンの移動から生じる正の電気勾配は、マグネシウムとカルシウムの受動的な細胞外輸送を刺激する。細胞間にあるタイトジャンクション、クローディン-16とクローディン-19は、再吸収に必要なマグネシウムの細胞外移動を可能にする。マグネシウムは近位尿細管と遠位尿細管でも再吸収されるが、その程度は低い。
ナトリウムの再吸収の主な部位は、Na+/K+-ATPaseとナトリウム-プロトン交換体を介した腎近位尿細管である。
塩化物イオンの再吸収の主要部位は、電気化学的勾配に駆動される受動的および傍細胞拡散を介した近位尿細管である。
アミノ酸とグルコースの再吸収の主要部位は近位尿細管であり、ナトリウム-プロトン交換体により、アミノ酸とグルコースの濃度勾配を下る受動的拡散が可能である。
カリウム再吸収の主要部位(65%)は近位尿細管である。
Eisenmenger syndrome
ASDは心房室間の異常な連絡によって生じ、血液の左から右へのシャントが起こる。
やがて肺高血圧の結果として右から左へのシャントが生じ、チアノーゼと低酸素症を引き起こす(アイゼンメンジャー症候群)。
ステップ1:病気の診断
この患者には右室拡大と頸静脈拡張があり、右室肥大と右室圧亢進を示唆している。ばち指は慢性低酸素症を示唆する。小児期のS2音の分裂と収縮期雑音は心房中隔欠損症(ASD)を示唆している。これらを総合すると、肺高血圧がRV圧の上昇を招き、右から左へのシャントがチアノーゼと低酸素症を引き起こすアイゼンメンジャー症候群といえる。
ステップ2:疾患のメカニズム
ASDでは、右心房への左から右への血流が増加する。このため、肺血管系全体に過負荷が生じ、肺高血圧症が発症する。右心室はこの肺血管抵抗に打ち勝つために余計に働かなければならず、その結果、肺静脈圧が高くなる。右心房内圧が上昇すると、左心室よりも高いレベルまで上昇し、最終的には右から左へのシャント(アイゼンメンジャー症候群)を引き起こす可能性がある。血液は肺をバイパスするため、患者はチアノーゼと低酸素血症を発症する。
動脈管開存症は、左鎖骨下部の連続的な機械音のような雑音を呈する。
僧帽弁閉鎖不全症は、心尖部で最もよく聞こえる全収縮期雑音を呈し、腋窩中部に放散する。
心室中隔欠損症では、左胸骨下縁に汎収縮期雑音を認める。
大血管転位は生後まもなくチアノーゼと息切れを呈する。
大動脈弁狭窄症では、右胸骨縁で最もよく聞こえる収縮期クレシェンド-デクレシェンド性雑音を呈し、頸動脈への放散を伴う。
出血によるBUN上昇
タンパク質の大量摂取、消化管出血、大量出血を伴う外傷があると、血清クレアチニンが増加しなくてもBUNが増加することがある。
ステップ1:疾病メカニズム
大量外傷を受けた患者は貧血でBUNが上昇している。通常、急性腎障害(AKI)では、BUNとクレアチニンの両方が一緒に上昇する。血清クレアチニンは糸球体濾過量(GFR)の低下を示す最良の指標であり、ここでは正常であることから、この患者はAKIではなく、BUN高値は尿素合成または再吸収の単独亢進によるものと考えられる。消化管出血によって消化管内で赤血球溶血が起こり、尿素産生が増加したためと考えられる。高タンパク食後や今回のように消化管出血がある場合、クレアチニンの上昇なしにBUNが上昇することがある。赤血球が腸内で溶血し、タンパク質が肝臓に取り込まれて尿素に異化され、BUNが上昇するのです。
Infective endocarditis
感染性心内膜炎は歯科手術の結果として発症することがあり、しばしば発熱、血液培養陽性、新たな心雑音を呈する。
感染性心内膜炎ステップ1:病気の診断
この患者は3ヵ月間の発熱と倦怠感、新しい僧帽弁閉鎖不全雑音を呈し、血液培養でS. epidermidisが陽性であった。最も可能性の高い診断は感染性心内膜炎(IE)であり、歯科治療中に生じた菌血症が原因と考えられる。IEは急性または亜急性の場合があり、今回のように数ヵ月にわたって発症する。最も一般的な原因はブドウ球菌(最も一般的なのは黄色ブドウ球菌)と一部の連鎖球菌である。
ステップ2:合併症
患者の手の病変はオスラー結節で、IE、ループス、播種性淋菌感染症でみられる。血尿と蛋白尿は、感染による二次性糸球体腎炎(GN)を示唆しています(感染後GN)。成人では、これはほとんどの場合、黄色ブドウ球菌または連鎖球菌感染によるもので、感染開始と同時または1~3日後に腎炎性糸球体疾患(赤血球、赤血球鋳型、軽度の蛋白)を呈する。これは、小児の溶連菌性咽頭炎や膿痂疹の10~14日後にみられる腎炎症候群(溶連菌感染後GN)とは対照的です。IEの他の合併症として、爪の下の飛沫出血や、手のひらや足の裏に痛みを伴わない病変であるJaneway病変があります。
ステップ3: 病気のメカニズム
感染後GNとオスラー結節は、どちらもIEでみられる感染に対する全身性免疫反応による二次的な免疫複合体の沈着によるものです。の合併症には、オスラー結節、点状出血、血尿や蛋白尿を伴う感染後GNがある。
感染後GNとオスラー結節はどちらも組織への免疫複合体の沈着が原因です。(塞栓ではない)
ステップ1:病気の診断
この患者は3ヵ月間の発熱と倦怠感、新しい僧帽弁閉鎖不全雑音を呈し、血液培養でS. epidermidisが陽性であった。最も可能性の高い診断は感染性心内膜炎(IE)であり、歯科治療中に生じた菌血症が原因と考えられる。IEは急性または亜急性の場合があり、今回のように数ヵ月にわたって発症する。最も一般的な原因はブドウ球菌(最も一般的なのは黄色ブドウ球菌)と一部の連鎖球菌である。
ステップ2:合併症
患者の手の病変はオスラー結節で、IE、ループス、播種性淋菌感染症でみられる。血尿と蛋白尿は、感染による二次性糸球体腎炎(GN)を示唆しています(感染後GN)。成人では、これはほとんどの場合、黄色ブドウ球菌または連鎖球菌感染によるもので、感染開始と同時または1~3日後に腎炎性糸球体疾患(赤血球、赤血球鋳型、軽度の蛋白)を呈する。これは、小児の溶連菌性咽頭炎や膿痂疹の10~14日後にみられる腎炎症候群(溶連菌感染後GN)とは対照的です。IEの他の合併症として、爪の下の飛沫出血や、手のひらや足の裏に痛みを伴わない病変であるJaneway病変があります。
ステップ3: 病気のメカニズム
感染後GNとオスラー結節は、どちらもIEでみられる感染に対する全身性免疫反応による二次的な免疫複合体の沈着によるものです。
嘔吐に対する尿細管の反応
嘔吐により胃の塩酸が失われ、体液が減少するため、代謝性アルカローシス(収縮性アルカローシス)が生じる。
収縮性アルカローシスに対する尿細管の反応は、近位での重炭酸塩再吸収の亢進と、アルドステロン駆動性の集合管からの水素イオン分泌の亢進である。
ステップ1:病気の診断
代謝性アルカローシスは、嘔吐による胃酸の喪失によって生じ、血管内容積の減少によって維持され、Cl反応性代謝性アルカローシスを生じている。
ステップ2:疾患メカニズム
細胞外液減少の結果、レニン・アンジオテンシン・アルドステロン系(RAAS)が活性化される。RAASの活性化はアンジオテンシンIIを活性化し、Na-水素アンチポーターの刺激により近位尿細管でのNa+/H+交換を増加させる。これにより、HCO3-の再吸収が増加する。さらに、アルドステロンは集合管のH+-ATPaseに作用して水素イオンを内腔に分泌し、代謝性アルカローシスを助長する。体内生理の変化は塩化物欠乏に起因し、尿細管におけるCl-/HCO3-交換不全につながる。したがって、患者は血清重炭酸濃度が高い。
近位尿細管による重炭酸塩再吸収の低下は、近位尿細管性アシドーシスやアセタゾラミドのような炭酸脱水酵素阻害薬で起こる。
集合管でのナトリウム再吸収の低下は、アミロリド、トリアムテレン、スピロノラクトンなどの利尿薬によって起こる。
脱水患者では、ADHが集合管内の細胞に結合して水分透過性を増加させることがある。しかし、ADHは酸塩基の状態に直接作用しない。
上行肢のNa+/K+/2Cl-共輸送体は、代謝性アルカローシスでは酸塩基平衡に積極的に寄与しない。
尿細管糸球体フィードバックは酸塩基状態に直接影響しない。
肝腎症候群(HRS) 脾動脈拡張
HRSは、腎虚血や他の腎障害を認めず、急速に発症するAKIを特徴とする。
HRSは脾動脈の血管拡張の直接的な結果であり、腎臓から腸への循環のシャントが起こり、腎血管収縮を引き起こし、クレアチニンの上昇、尿量の減少、良性尿毒症、尿中ナトリウム濃度が20mEq/L未満となり、正常食塩水の静脈内投与に反応しなくなる。
ステップ1:病気の診断
この患者は肝硬変であり、現在、腹水穿刺後に血清クレアチニンが上昇している(急性腎障害[AKI])。尿検査は正常で、尿中ナトリウムは20mEq/L未満であるが、生理食塩水を投与しても改善しない。このことから、肝腎症候群(HRS)が疑われる。HRSの特徴は、腎虚血、尿細管壊死、間質性腎炎を認めず、急速に発症する腎障害である。大量穿刺はHRSの一般的な前駆症状であり、この診断を支持している。
ステップ2:疾患機序
HRSは脾動脈の血管拡張の結果であり、腎臓から腸への循環シャントが起こる。腎臓から血液がシャントされると、腎血管収縮とAKIのサイクルが進行する。
Coronary artery spasm
ステップ1:病気の診断
安静時および労作時に断続的な胸痛があり、ニトログリセリンの舌下投与で軽快する。心電図所見は冠動脈の閉塞を示さない。彼女は、冠動脈の攣縮に起因する胸痛の珍しい原因である変型(Prinzmetal, vasospastic)狭心症に罹患している可能性が高く、しばしば喫煙によって誘発される。冠動脈造影では冠動脈は正常である。
Spironolacton
スピロノラクトンは、CHFの代替薬として使用されるカリウム保持性利尿薬であり、高カリウム血症および代謝性アシドーシスを引き起こす可能性がある。スピロノラクトンはアルドステロンの受容体を阻害する。
ステップ1:薬の副作用
スピロノラクトンはアルドステロンの作用に拮抗するため、高カリウム血症や代謝性アシドーシスを引き起こす可能性がある。アンジオテンシン変換酵素阻害薬やアンジオテンシン受容体拮抗薬も心不全に用いられるが、これらの薬剤が代謝性アシドーシスを引き起こすことはあまりない。
ステップ2:薬物機序
スピロノラクトンは競合的アルドステロン受容体拮抗薬として機能する。アルドステロン受容体を阻害し、水とナトリウムの再吸収を減少させ、カリウムの排泄を減少させる。